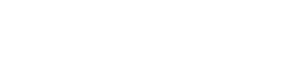

在体外诊断领域常用的方法学中,无论是免疫层析或是板式ELISA,胶乳免疫比浊或是磁微粒化学发光,或是更新的微流控技术,只要涉及了固相介质及免疫反应,都需要考虑由于反应体系中的蛋白质或生物分子与固相介质间的非特异性吸附,而给反应的特异性和灵敏度带来的负面影响。
特异性结合是一对一结合,专一性结合,比如,酶-底物、抗原-抗体、配基-受体之间的相互辨别和选择性结合反应。从立体结构角度上说,就是相应的反应物之间构象存在对应性。与之相反,非特异性吸附是一种无差别的,没有选择性的吸附,反应物之间也不存在结构对应性。这类非特异吸附往往会使结果出现出现假性升高,即假阳性现象。引起此现象的物质可分为内源性及外源性物质。
外源性干扰:包括样本凝固不全、样本溶血、脂血等性状影响、样本保存时间过长及保存不当等因素,一般可通过离心等操作解决。
内源性干扰:相较于外源性干扰,内源性干扰较难被直接识别与消除,只能采取额外的去除干扰抗体/阻断干扰抗体的方法来得到正确的检测结果。
尽管有文献建议发展新方法以回避现行的基于免疫检测方法中的干扰因素,但实际上,目前没有任何方法能完全规避内源性干扰的影响。常见的内源性干扰包括异嗜性抗体、人抗动物抗体、 Hook效应、类风湿因子等。
内源性因素中异嗜性抗体是常常引起假阳性的重要原因。异嗜性抗体(heterophile antibody, HA)是由已知或未知的抗原物质刺激人体免疫应答产生的一类抗体,一般情况下,抗原暴露后人体免疫系统开始识别抗原并逐步产生亲和力不断提高的相关抗体。但在此过程中,同时也产生了低亲和力和非特异性的抗体[1],通常能与2种或以上的抗原发生反应,属于亲和力较低的结合反应。所以即使在没有待测抗原的情况下,也能导致检测结果的假性升高。
异嗜性抗体可识别多种化学结构和自身抗原[2]。试剂盒组份中的 M 磁微粒表面存在各种化学基团(如经过修饰的甲苯磺酰基、羧基或链霉亲和素),或者对磁珠表面进行封闭时也会用到一些大分子蛋白,非特异性抗体可能会与这些基团或大分子蛋白结合[3-5],并在第二步反应时结合 R2 碱性磷酸酶(AP)标记的鼠抗人 IgG,从而干扰体外免疫检测产生非特异性信号,导致各种自身抗体检测结果为全阳。异嗜性抗体导致的非特异性吸附基于目前的免疫检测技术无法完全避免[6]。
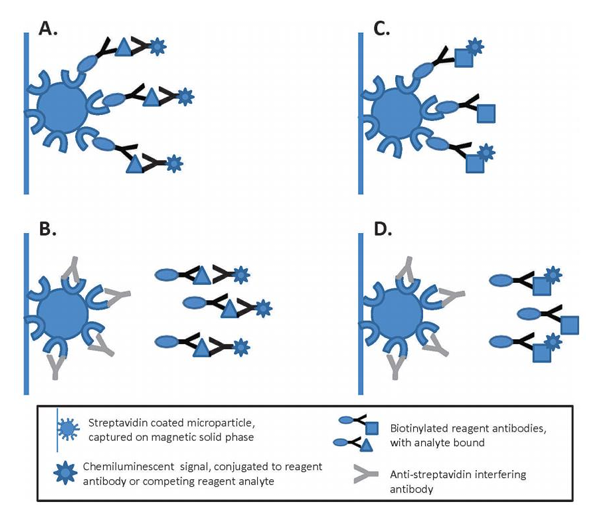
图1 非特异性抗体对Roche E170检测系统的干扰
【案例经过】
某三甲医院反馈:肾病血液内科某患者:男,84岁,临床诊断:慢性心功能不全急性加重,肾功能不全,高钾血症。
在初次临床样本检测结果显示:
间接免疫荧光:ANA(阴性);
磁微粒化学发光:Nuc、nRNP/Sm、Sm、Scl-70、His五项均为阳性测值,如图2所示;
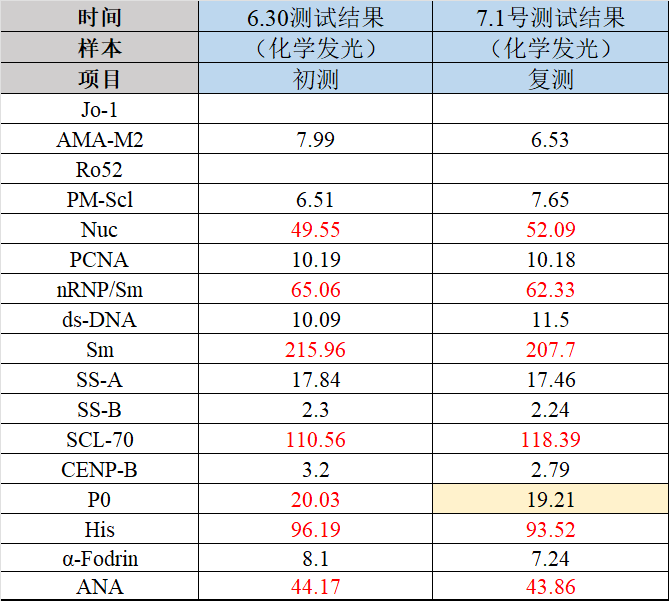
图2 化学发光测值结果(初测+复测)
【结果分析】
第一步:工程师第一时间前往医院核对了样本信息、测值信息,无异常;并检查了校准数据与当日质控,结果显示:Nuc、nRNP/Sm、Sm、Scl-70、His五项当日质控的高低浓度水平均在1倍SD以内;同时工程师检查了最近一周的质控和样本测值情况、检测仪器基础性能和公共耗材,经过充分验证后也均未发现异常。
第二步:间接免疫荧光检测为阴性,工程师查阅文献发现:在临床样本检测中会出现 ANA(间接免疫荧光)阴性,而抗核抗体单项(定量检测)阳性的结果,且文献研究报道的概率约为 2%-6%。(来源:《两种抗体阳性对抗核抗体阴性的确证试验价值探讨》-中华检验医学杂志,2003,26:237.)。
但临床诊断并未有明确的自免疾病关联性;于是保险起见工程师将此例样本寄回公司研发分析复测。
第三步:经过研发验证,该患者样本存在异嗜性抗体干扰问题。研发通过阻断干扰抗体的方法处理后得到正确结果并与欧蒙ELISA比对,比对结果一致性高(见图3)。
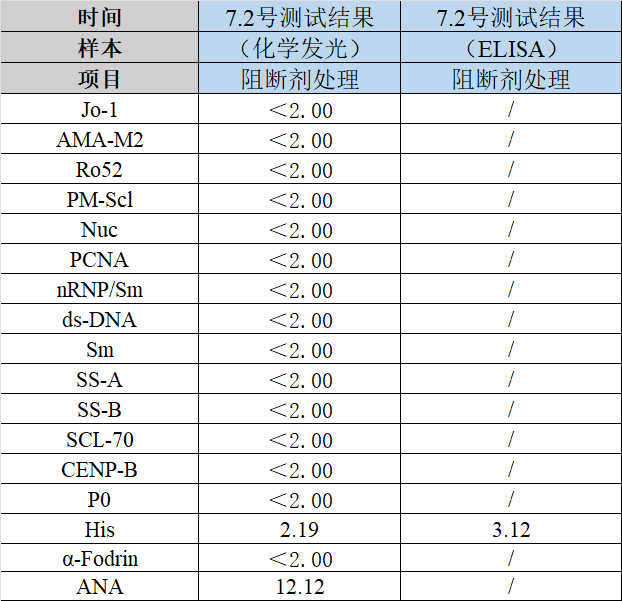
图3 样本处理结果
【案例总结】
问:如何发现和处理异嗜性抗体对免疫项目检测的干扰?
答:当同一份样本在检测多个项目,出现多个项目同时阳性(包括临界阳性),尤其是与不同疾病相关的项目同时阳性时,高度提示异嗜性抗体干扰的存在。自身抗体作为自身免疫性疾病的血清学检测指标,检测结果应结合临床检查、病史和其它相关资料作出诊断。
此外,携光生物提供的非特异性样本处理剂,可以对样本中的非特异性物质进行吸附,并通过离心或磁分离除去,减少由非特异性结合造成的异常结果,同时对特异性的抗体与抗原的特异性结合没有影响。
在《抗核抗体检测的临床应用专家共识(2018年版)》中原文描述,ANA 特异性自身抗体可采用多种免疫学方法检测,不同的检测方法具有不同的临床应用优缺点。如 ELISA 具有高敏感性、定量及易自动化的优点,但需对每个自身抗体进行逐项检测。线性免疫印迹法具有高敏感性、易操作、易自动化及一次实验操作可同时检测多种自身抗体的优点,但其检测结果为半定量,某些自身抗体的特异性偏低。化学发光免疫分析(CLIA)具有高敏感性、高特异性、定量及自动化的优点,但检测成本高、需对每个自身抗体进行逐项检测。因化学发光法高灵敏度、全定量检测的优势,在2020年《自身免疫病抗体检测方法的推荐意见》也推荐CLIA用于多种自身抗体的检测。因此CLIA对自身抗体的定量检测结果能为临床提供更多的参考,符合自身抗体检测的临床需求和发展趋势。同时,因CLIA为单指标检测,可根据疾病临床诊断路径对相应的指标进行单独或组合检测,不必每次进行全套自身抗体谱检测,因此,可以降低医保及患者负担。
[1] Levinson S, Miler J. Towards a beter understanding of hetrophile (and the like) antibody interfernce with modern imunoasays [J]. Clinca Chimca Acta 325 (202): 1-5.
[2] Boscato L M and Stuart M C. Heterophilic antibodies: a problem for all immunoassays.[J]. Clinical chemistry, 1988, 34(1) : 27-33.
[3] Rulander NJ, Cardamone D, Senior M, Snyder PJ, Master SR. Interference from antistreptavidin antibody.[J]. Arch Pathol Lab Med 2013;137:1141–6.
[4] Peltier L, Massart C, Moineau MP, Delhostal A, Roudaut N. Antistreptavidin interferences in Roche Thyroid immunoassays: a case report [letter]. Clin Chem Lab Med 2016;54:e11–4.
[5] Khieng V, Stevens C. Vitamin D toxicity? a case study. NZ J Med Lab Sci 2010;64:44–50.
[6] Bolstad N. Heterophilic Antibody Interference in Immunometric Assays[J]. 2020.